Czułe i specyficzne nanosensory potasu do wykrywania napadów padaczkowych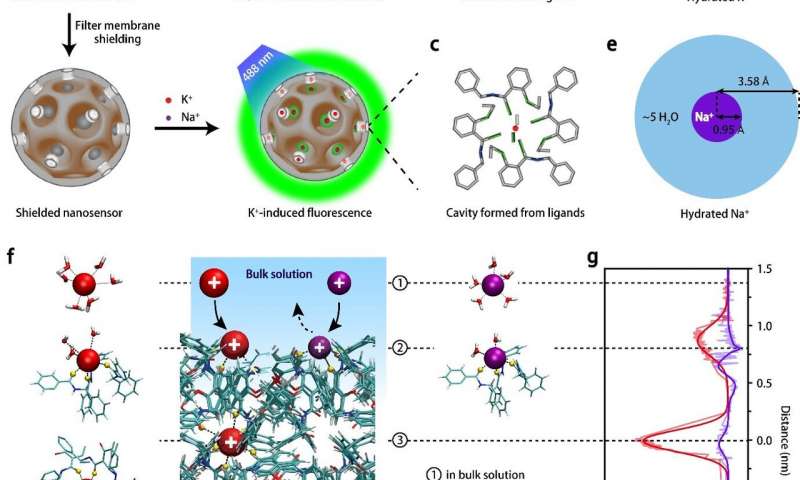
Naukowcy z Center for Nanoparticle Research, w ramach Institute for Basic Science (IBS, Korea Południowa) we współpracy ze współpracownikami z Uniwersytetu Zhejiang w Chinach, zgłosili wysoce czuły i specyficzny nanosensor, który może monitorować dynamiczne zmiany jonów potasu u myszy poddawanych napadom padaczkowym, wskazując na ich intensywność i pochodzenie w mózgu. Padaczka jest zaburzeniem ośrodkowego układu nerwowego, któremu towarzyszy nieprawidłowa aktywność mózgu, powodująca napady lub okresy nietypowego zachowania, odczucia, a czasami utrata świadomości. Jeżeli napady padaczkowe trwaj± przez 30 minut lub dłużej, mog± spowodować trwałe uszkodzenie mózgu, a nawet ¶mierć. Potrzeba technologii do oceny stopnia zaburzeń aktywności elektrycznej związanych z padaczką jest dobrze znana. Jednym z głównych celów badań jest jon potasowy (K+). Jon ten wpływa na różnicę w potencjale elektrycznym pomiędzy wewnętrzną i zewnętrzną błoną neuronów, a także wpływa na pobudliwość wewnętrzną neuronów i transmisję synaptyczną. Pomimo znacznych wysiłków mających na celu poprawę selektywności czujników K+, są one nadal dalekie od zadowalających, ponieważ obecnie dostępne reportery optyczne nie są w stanie wykryć niewielkich zmian w jonach potasu, w szczególności u swobodnie poruszających się zwierząt. Ponadto są one podatne na zakłócenia jonami sodowymi, ponieważ zaraz po napływie Na+ następuje wypływ K+, gdy impulsy przechodzą przez błonę komórki nerwowej. W niniejszym opracowaniu, opublikowanym w Nature Nanotechnology, badacze opisują wysoce czuły i selektywny nanosensor K+, który może monitorować zmiany K+ w różnych częściach mózgu swobodnie poruszających się myszy. Nowy nanosensor tworzony jest z porowatych nanocząsteczek krzemionki osłoniętych ultracienką membraną przepuszczającą potas, która jest bardzo podobna do kanału potasowego w komórkach mózgowych. Wielkość porów pozwala na dyfuzję tylko K+ do wewnątrz i na zewnątrz, osiągając granicę wykrywalności nawet 1,3 mikrometra. Pozwala to na specyficzny odczyt submilimolarnych zmian pozakomórkowego K+ i mapowanie przestrzenne tego jonu w mózgu. Badanie to wykazało, że filtr membranowy z membraną przepuszczalną K+ na nanosensorze jest skuteczny w odfiltrowywaniu innych kationów i wychwytywaniu wyłącznie jonów K+. Taka strategia budowy nanosensorów przyczyniłaby się nie tylko do odkryć naukowych i przełomów w badaniach neurologicznych, ale również do rozwoju innych selektywnych czujników jonowych. Wykorzystując te nanosensory w regionie hippokampalnym CA3, zespół mógł zgłaszać stopień napadów padaczkowych u żywych myszy i porównywać go z zapisami aktywności neuronowej wykonanymi za pomocą elektroencefalografii (EEG). Aby dodatkowo sprawdzić, czy nanosensory są zdolne do pomiaru K+ w wielu podregionach mózgu u myszy żyjących w swobodnym ruchu, naukowcy wstrzyknęli nanosensory w trzy różne miejsca mózgu myszy: hipokamp, migdał i kora mózgowa. Po stymulacji elektrycznej w hipokampie jednocześnie rejestrowano EEG i odpowiedzi optyczne nanosensorów w wstrzykiwanych miejscach. Co ciekawe, zewnętrzne stężenie K+ wzrasta od hipokampu do migdałków i kory mózgowej w czasie w napadach ogniskowych, podczas gdy wzrasta prawie jednocześnie w trzech regionach mózgu w napadach uogólnionych. Wyniki te są zgodne z powszechnie przyjętym poglądem, że stymulacja elektryczna w hipokampie najpierw obejmuje sąsiedni obszar mózgu, a następnie rozprzestrzenia się w całym mózgu. Hyeon Taeghwan, dyrektor IBS Center for Nanoparticle Research (Distinguished Professor at Seoul National University) i czołowy autor badania zauważa: "Dalszy rozwój tych nanosensorów mógłby ułatwić diagnozę i terapię, zmniejszając potrzebę operacji. Najlepiej byłoby, gdyby te nanosensory zawierały również leki przeciwpadaczkowe, które miałyby być uwalniane we właściwych miejscach mózgu, w których powstały napady". Wróć na stronę główną |
mag-met.pl forumdlamam.pl
blogizon.com
anpol.net.pl
decor-house.com.pl
Alicja.co.pl Archiwum.co.pl Arena.co.pl Bloger.co.pl Blogi.co.pl Co si� Dzieje.co.pl Co Nowego.co.pl Czas.co.pl Czytelnia.co.pl i24.co.pl Info24.co.pl Informator.co.pl Jola.co.pl Julkasz.co.pl Korona.co.pl Kraina.co.pl Kraj.co.pl Kuba.co.pl Latek.co.pl Link Informacyjny.co.pl Ludzie.co.pl Magazyn.co.pl Media.co.pl Melka.co.pl Mirek.co.pl M�wi si�.co.pl Najlepsze.co.pl News24.co.pl Normal.co.pl Planeta.co.pl Polska24.co.pl Popularne.co.pl
https://blogiant.com/
https://superportal.net/
https://aktualnosci.co.pl/
https://anastazja.co.pl/
https://domek.co.pl/
https://gospodarze.co.pl/
https://infobiznes.co.pl/
https://med.co.pl/
https://nazdrowie.co.pl/
https://newsy.co.pl/
https://portfel.co.pl/
https://styl.co.pl/
https://dziendobry.co.pl/
https://bank-informacji.co.pl/
https://blogaska.co.pl/
https://imbirowo.co.pl/
https://lubiszto.co.pl/
https://planeta-wnetrz.co.pl/
https://stronabiznesowa.co.pl/
https://temat24.co.pl/
https://naszdom.co.pl/
https://zdrowastrona.co.pl/
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
http://grzejnikeco.pl/
https://www.noclegi-krakow.org.pl/
https://uniface.pl/
https://laudate.pl/
https://siteworld.pl/
https://virango.pl/
https://szort.pl/
https://wzsp.pl/
http://isoverexpress.pl/
https://go4all.pl/
https://www.siwak.com.pl/
http://www.gierki.org/
https://netsharemediagroup.pl/
World:
https://newspaper.co.pl/
https://earth.co.pl/
https://blogasek.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://ciekawostki.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://informacje.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://lifestyle.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://okay.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://blogasek.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://ciekawostki.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://earth.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://informacje.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://lifestyle.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://newspaper.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://okay.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/ 4
4
4
4
4
4
4 https://blogasek.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://blogasek.co.pl/kontrola-covidowa-w-zakladach-pracy https://ciekawostki.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://ciekawostki.co.pl/kontrola-covidowa-w-zakladach-pracy https://earth.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://earth.co.pl/kontrola-covidowa-w-zakladach-pracy https://informacje.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://informacje.co.pl/kontrola-covidowa-w-zakladach-pracy https://lifestyle.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://lifestyle.co.pl/kontrola-covidowa-w-zakladach-pracy https://newspaper.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://newspaper.co.pl/kontrola-covidowa-w-zakladach-pracy https://okay.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://okay.co.pl/kontrola-covidowa-w-zakladach-pracy
https://www.noclegi-krakow.org.pl/
https://uniface.pl/
https://laudate.pl/
https://siteworld.pl/
https://virango.pl/
https://szort.pl/
https://wzsp.pl/
http://isoverexpress.pl/
https://go4all.pl/
https://www.siwak.com.pl/
http://www.gierki.org/
https://netsharemediagroup.pl/
World:
https://newspaper.co.pl/
https://earth.co.pl/
https://blogasek.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://ciekawostki.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://informacje.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://lifestyle.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://okay.co.pl/faktami-w-endometrioze-medicover-odpowiada-na-najpopularniejsze-pytania-pacjentow/
https://blogasek.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://ciekawostki.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://earth.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://informacje.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://lifestyle.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://newspaper.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/
https://okay.co.pl/europoslowie-nawoluja-do-zaprzestania-zmian-czasu/ 4
4
4
4
4
4
4 https://blogasek.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://blogasek.co.pl/kontrola-covidowa-w-zakladach-pracy https://ciekawostki.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://ciekawostki.co.pl/kontrola-covidowa-w-zakladach-pracy https://earth.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://earth.co.pl/kontrola-covidowa-w-zakladach-pracy https://informacje.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://informacje.co.pl/kontrola-covidowa-w-zakladach-pracy https://lifestyle.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://lifestyle.co.pl/kontrola-covidowa-w-zakladach-pracy https://newspaper.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://newspaper.co.pl/kontrola-covidowa-w-zakladach-pracy https://okay.co.pl/400-tysiecy-zlotych-musi-zwrocic-gmina https://okay.co.pl/kontrola-covidowa-w-zakladach-pracy